Degré alcoolique d'une substance alcoolique
Le titre alcoométrique volumique, aussi appelé degré alcoolique, est la proportion d'alcool, c'est-à-dire d'éthanol, contenue dans une boisson alcoolisée. Il est égal au volume d'alcool (en cl) présent dans 1L de cette boisson, ces volumes étant tous deux mesurés à la température de 20°C. L'unité utilisée pour exprimer le titre est le pourcentage volumique (% vol) ou degré (noté °).
Connaître le titre alcoométrique volumique de son ditillat est très important pour le distillateur, à la fois pour des questions de règlementations, et des questions de goût. Il faut savoir que les alcools de fruits ont un degré alcoolique le plus souvent compris entre 38° et 42°, et pour obtenir un titre alcoométique volumique aussi précis, il faut ajouter une quantité d'eau très précise. Cette quantité d'eau varie selon le volume de la substance initiale, le titre alcoométrique volumique initiale et le titre alcoométrique volumique recherché.
On doit donc tout d'abord connaître le titre alcoométrique volumique dans la substance initiale. Pour celà, le distillateur peut avoir recours à différentes techniques, deux desquels nous allons détailler.
A) L'aréomètre- l'alcoomètre
Ce que l'on appelle aujourd'hui alcoomètre, est en réalité une dérivée de l'aréomètre, appareil qui existe depuis l'antiquité.
L'aréomètre est un instrument flotteur destiné à faire connaître le poids spécifique des corps liquides ou solides, ou bien le degré de concentration de certains liquides. Un aréomètre est composé d'une carène cylindrique creuse en verre, lesté avec du plomb ou du mercure, pour abaiser son centre de gravité pour qu'il puisse ainsi se tenir en équilibre stable dans le liquide dans lesquel il est immergé. Une tige cylindrique creuse en verre graduée est soudée sur le carène.
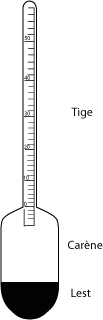
Aréomètre Baumé
Shéma représentant une aréomètre Baumé
Moins le liquide dans lequel l'aréomètre est plongé est dense, plus l'aéromètre s'enfonce dans celui-ci, selon le principe d'Archimède " Tout corps plongé dans un liquide reçoit une poussée égale au poids du volume de liquide déplacé". Le fonctionnement de aréomètre est en effet basé sur ce principe. Il s'agit de déterminer la concentration d'un mélange, en mesurant sa densité. L'aréomètre est donc un densimètre.
Soit : V le volume du flotteur (carène)
M la masse totale de l'appareil
μ la masse volumique du liquide
μe la masse volumique de l'eau (1 g/cm3)
S la section de la tige
X la longueur de la tige immergée dans le liquide
d la densité du liquide
Sachant que le poids est égal à M.G, G étant la constante gravitationnelle (9,81),
A l'équilibre, la poussée d'Archimède est égale au poids de l'aréomètre:
M.G = μ.(V + S.X).g
M.G = (V + S.X).g.d.μe
donc d = M / (V + S.X)
Les premières descriptions de l'aréomètre remontent à l'antiquité, et Galilée a décrit cet instrument en 1612, mais c'est essentiellement Antoine Baumé, pharmacien et chimiste français (1728-1804), qui a développé cet instrument, mais en utilisant des graduations arbitraires. L'aréomètre de Baumé permet d'évaluer la densité, et donc la concentration de n'importe quelle solution avec la même unité (degré Baumé) et le même instrument. Mais le degré Baumé n'est aujourd'hui plus utilisé. Il existe deux différents types d'aréomètres : l’aréomètre à volume constant, où l’on fait varier le poids de l’appareil en ajoutant ou retirant des masses sur un plateau, et l’aréomètre à poids constant, où l’on mesure le volume immergé, grâce à une tige graduée.
En 1824, Gay-Lussac (1778-1850) perfectionne ensuite l'aréomètre à poids constant pour le spécialiser dans la mesure des alcools, suite à une demande officielle en vue d'une taxation sur les alcools. Il baptise ce nouveau aréomètre l'alcoomètre. Il invente sa propre unitée de mesure, le degré Gay-Lussac (°GL), tel qu'à la température de 15°C, si un mélange de 100cm3 contient 1cm3 d'alcool pur, alors ce mélange est à 1°GL. Pour graduer son alcoomètre, il le plonge dans de l'eau pure à 15°C et marque 0 le l'endroit où la tige touche la surface de l'eau. Puis il le plonge dans de l'alcool pur à 15°C et a fait de même avec la graduation 100. Ainsi, 0°GL correspond à de l'eau pure, et 100°GL à de l'alcool pur. Il gradue ensuite la tige à l'aide de mélanges eau-alcool dont il connaît les proportions. Biensur, pour que les résultats de l'alcoomètres soient fiables, il est important que le mélange contienne uniquement de l'eau et de l'alcool, d'où la nécéssité de distiller le mélange avant la mesure.
 Alcoomètre moderne
Alcoomètre moderne
L'alcoomètre utilise donc exactement le même mode de fonctionnement que l'aréomètre, c'est en quelque sorte un densimètre spécialisé dans la mesure de l'alcool. Il est aujourd'hui utilisé par des distillateurs du monde entier. Le degré Gay Lussac quant à lui, est encore utilisé dans de nombreux pays, mais il est maintenant de plus en plus remplacé par le pourcentage d’alcool en volume, 1°GL équivaut à 1% vol.
B) La chromatographie
On peut également mesurer le degré d’alcool par chromatographie. En 1901, un botaniste russe, Mikhail Semenovich TSWETT, invente la chromatographie durant ses recherches sur les pigments végétaux. La première utilisation du terme de “chromatographie” apparaît en 1906. C’est une technique analytique qui permet la séparation des constituants d'un mélange en homogène liquide ou gazeux. Nous allons détailler la le principe utilisé pour les mélanges liquides, car nous nous interessons à l'alcool : la chromatographie sur couche mince.
Le principe repose sur les différences d'affinités de la substance par rapport à deux phases : l'une stationnaire, l'autre mobile. La phase stationnaire est fixée sur une planche, et la phase mobile est liquide et est composée d'un solvant ou d'un mélange de solvants, on l'appelle l'éluant. Après que l’échantillon ait été déposé en petite quantité sur la phase stationnaire, on la fait tremper dans la phase mobile, de façon à ce que celle-ci se mélange à l'échantillon. Les substances vont ensuite "monter" à travers la phase stationnaire par capillarité, à une vitesse qui dépend de leur nature ainsi que de celle de l'éluant (phase mobile) et de la phase stationnaire, car il va se former des interactions electrostatiques entre ces trois composés. Ainsi, l'échantillon va monter haut si il a de fortes interactions avec l'éluant, ou si il a de faibles interactions avec la phase stationnaire, et inversement, il va rester bas si il a de faibles interactions avec l'éluant ou des fortes interactions avec la phase stationnaire. Les différents composants de l'échantillon ont généralement une vitesse caractéristique qui permet de les séparer, voire de les identifier.
En utilisant cette technique, on peut ainsi détecter l'alcool et déterminer à quel pourcentage il est présent dans l'échantillon, et donc dans l'eau de vie complète. Il existe des machines spécialisés dans la chromatographie, possédées par certaines distilleries.
Grâce à l'une de ces techniques, l'on connait maintenant le degré de notre alcool de façon précise, et l'on peut procéder à la dillution du schnaps. Il s'agit maintenant de déterminer quelle quantité d'eau il faut ajouter à notre eau de vie pour qu'elle atteigne le degré voulu.
Imaginons que l'on a 100L d'eau de vie, et que celle-ci a une concentration de 70% vol. On veut baisser le pourcentage d'alcool en volume à 45% vol :
70% de 100L = 70x100/100
= 70L
L'on sait maintenant que nos 100 litres de schnaps contiennent 70L d'alcool pur. Nous devons maintenant trouver la quantité n d'eau à ajouter pour que les 70L d'alcool deviennent 45% de la solution :
70 = (45.(n+100))/100
70 = (45n + 4500)/100
70 = 45n/100 + 4500/100
70 = 45n/100 + 45
25 = 45n/100
45n = 25*100
45n = 2500
n = 2500/45 = 55.6L
Il faut donc ajouter 55.6L d'eau à notre schnaps pour que la concentration de celui-ci soit de 45% vol.
Calcul de la quantité de matière:
Grâce au titre alcoométrique volumique, nous pouvons aussi calculer la quantité de matière d’éthanol contenue dans 1 litre de schnaps (ceci n'est pas utile si l'on est distillateur) :

Sachant qu’il faut environ 17g de sucre fermentescible pour atteindre 1° d’alcool dans un litre de schnaps et sachant aussi que le schnaps titre en moyenne 45° d’alcool par litre, on peut calculer la quantité de matière d’éthanol dans un litre de vin.
n0(C6H12O6) -xmax = 0 <=> xmax = n0(C6H12O6)
m0(C6H12O6) = 45x17 = 765 et M(C6H1206) = 180g.mol-1
n0(C6H12O6) = m0(C6H12O6)/M(C6H12O6)
= 765/180
= 4.25 mol
xmax = n0(C6H12O6) = 1,23 mol
nfinal(CH3-CH2-OH) = 2xmax = 8.5
Le schnaps contient donc au final environs 8.5 mol d'éthanol par litre.
page précédente - page suivante


